2021 ASCO | 重点研究进展汇总
发布时间:2021-06-15作者:2021年美国临床肿瘤学会(ASCO)年会于今年6月4日至8日在线上召开,本文汇总了2021ASCO年会上肺癌、乳腺癌、胃癌等肿瘤治疗领域的最新研究结果。
— 肺癌 —
【EGFR】阿美替尼一线治疗:中位PFS为19.3个月,史上最长,但OS未成熟
阿美替尼是国产三代EGFR-TKI,已经被CSCO指南推荐用于EGFR突变阳性患者的二线治疗,此次ASCO公布了阿美替尼一线治疗EGFR突变的NSCLCL患者的疗效,将已有的EGFR的一线治疗格局再次打破。
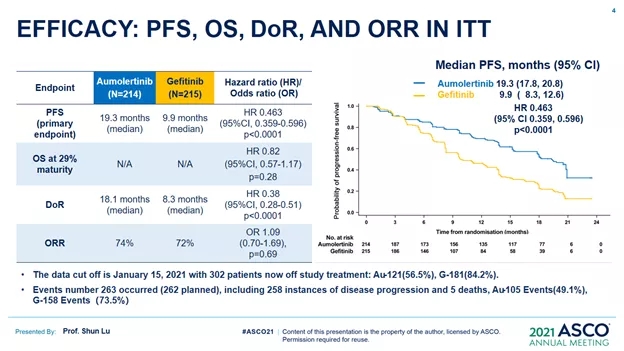
AENEAS研究研究一项评估阿美替尼对比吉非替尼一线治疗EGFR突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的随机、对照Ⅲ期临床研究。截至2018年11月30日至2019年9月6日,共纳入429例未经治疗的EGFR突变的局部晚期或转移性NSCLC患者,且入组患者均为中国患者。按照1:1比例随机分配至试验组予阿美替尼110mg每日一次口服或试验组予吉非替尼250mg每日一次口服,根据RECIST1.1每6周评估一次,直至疾病进展。主要研究终点为无进展生存期(PFS),次要研究终点包括总生存期(OS)、客观缓解率(ORR)、持续缓解时间(DoR)、疾病控制率(DCR)、肿瘤缓解深度(DepOR)及安全性。
结果显示,该研究达到了主要研究终点。相对于吉非替尼,阿美替尼显著延长了PFS(19.3个月vs 9.9个月,HR 0.436,p<0.0001)和中位DoR(18.1m vs 8.3m HR 0.38 , p<0.0001),但中位os尚未达到。安全性方面,阿美替尼组安全可控。(#9013),可惜的是os还未报道出来,毕竟我们从1代或者2代egfr-tki身上看到很多pfs获益但os未获益的情况,所以对阿美替尼的os数据还是非常期待的。虽然os数据未成熟,但单看pfs,确实是有史以来最长pfs。<>
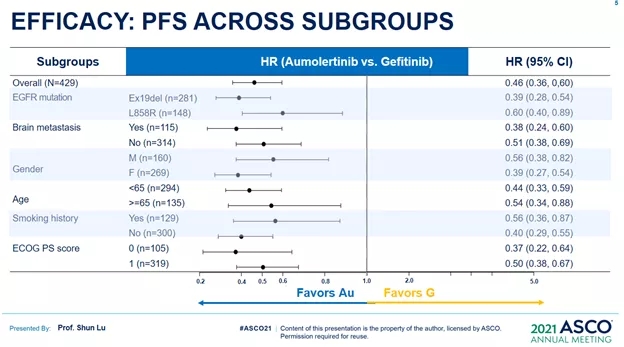
不同亚组分析结果显示,阿美替尼在各亚组中的PFS获益均优于吉非替尼。令人惊喜的是,阿美替尼在脑转移亚组中有更好的疗效,其疾病进展风险降低了62%。
安全性方面:与吉非替尼组相比,阿美替尼组治疗后皮疹、腹泻、AST/ALT升高及治疗相关严重不良事件的发生率更低,整体可控。
【EGFR】直面奥希替尼耐药:Amivantamab联合 lazertinib治疗,整体ORR36%
耐药一直是EGFR-TKI逃不掉的魔咒,今年ASCO大会将不同的EGFR-TKI耐药机制以及不同时期使用EGFR-TKI耐药机制进行了再次描述
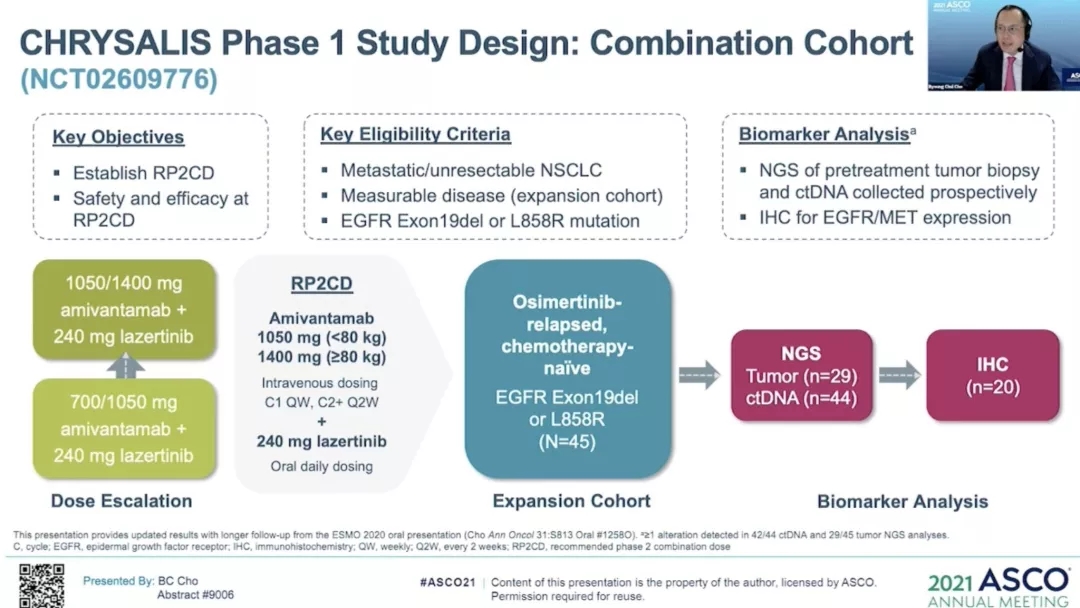
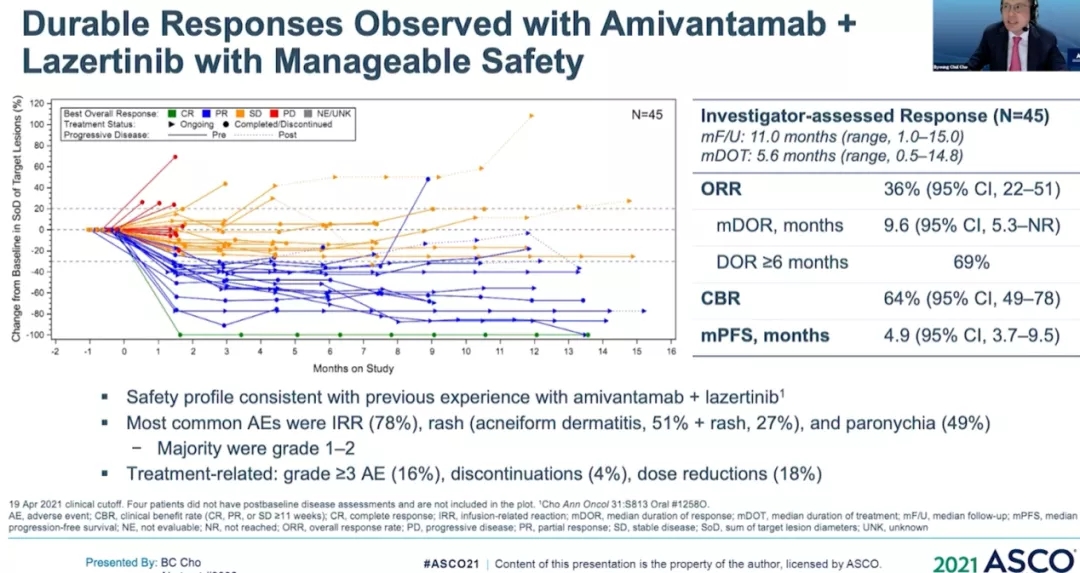
Amivantamab是一种EGFR/MET双靶单抗,5月22日刚被FDA批准成为首个治疗EGFR 20ins的靶向药物。拉泽替尼(Lazertinib)则是新型口服第三代EGFR靶向药。去年ESMO年会报道了JNJ-372(1400mg)+拉泽替尼(240mg)治疗45例奥希替尼治疗复发的患者的研究,其中奥希替尼耐药且未接受过化疗的患者的ORR为36%(1例完全缓解CR,15例患者部分缓解PR)。中位随访8.2个月,发现44%的患者仍在接受治疗,69%的肺癌患者持续反应,中位反应持续时间尚未达到(NR),中位无进展生存期(mPFS)为4.9 个月。
但是,通过生物标记物分析,29例患者经NGS评估,44例患者行ctDNA评估。基因检测确定了17例生物标志物阳性患者,其中8例(47%)有反应。其余 28 例患者中有18例患者的耐药机制未知,但8例(29%)对治疗有反应,其余10例患者属于非EGFR/MET耐药机制(无应答)。

45例患者中有20例患者在做完NGS检测后又做了IHC,其中10例阳性,10例阴性。针对10例IHC+的患者中有9例(90%) IHC 高(EGFR+MET H组合评分>400)患者对治疗有反应,而10例IHC低患者仅1例(10%)对治疗有反应。

【EGFR 20ins】Mobocertinib治疗铂类经治的NSCLC,DCR为78%,有望成为第二款20ins靶向药
EGFR外显子20插入突变(EGFR 20 ins)大约占到所有EGFR突变NSCLC的9%,预后较差。近期针对该突变形式,市场上迎来了一波热潮。5月份,FDA刚批准了Amivantamab用于治疗EGFR 20ins的首款靶向药物。此外今年ASCO 第一天还报道了迪哲的新药DZD9008治疗20insd的II期临床试验疗效。本次ASCO披露了来自武田制药研发的一款小分子EGFR/HER2抑制剂Mobocertinib(TAK-788)治疗114例铂类经治队列和EXCLAIM扩增队列的疗效。
EXCLAIM研究队列(n=96):接受TAK-788(160mg)中位治疗时间为6.5个月,独立审查委员会(IRC)评估的ORR为25%(24/96)、DCR为78%;研究者评估的ORR为32%(31/96)、中位无进展生存期(PFS)为7.3个月,中位DOR未达到,中位OS尚未到达。
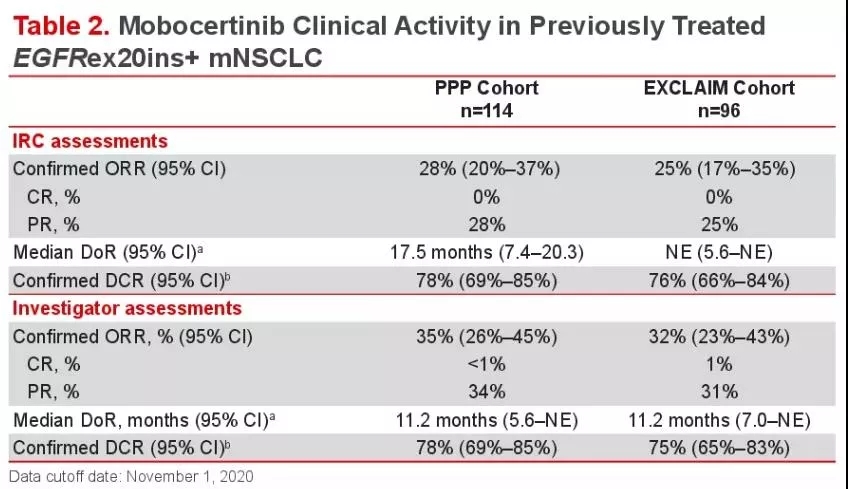
铂类经治的患者(n=114):接受TAK-788中位治疗时间为7个月,IRC确认的ORR为28%(32/114),DCR为78%,中位PFS为7.3个月,中位OS为24个月。针对不同的插入突变的位置以及形式,TAK-788疗效并没有太大差异。亚组分析显示,无论患者是否接受过EGFR-TKI治疗、免疫治疗,或不同的EGFR exon 20ins突变亚型,都观察到mobocertinib的治疗获益。2021年4月28日,FDA已批准优先审评武田的mobocertinib(TAK-788)新药申请(NDA),用于治疗EGFR 20ins 并已接受过铂类化疗治疗的转移性NSCLC患者。

【MET】MET跳跃突变和MET扩增,使用靶向药物疗效不同
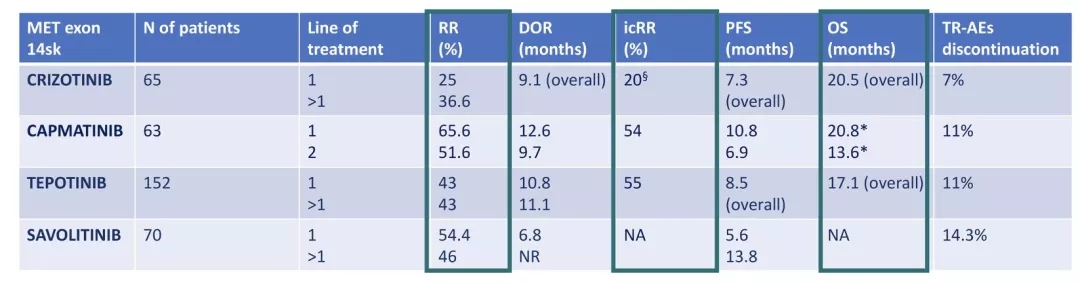
MET的突变形式主要包括MET14号外显子的跳跃突变和MET的扩增,其中1-5%的NSCLC患者会发生MET扩增。目前针对MET靶点的NSCLC患者,获批了四个靶向药物,克唑替尼、替泊替尼和卡马替尼以及塞沃替尼。今年ASCO报道了不同的MET-TKI治疗不同的TKI,疗效显然不一样。整体来看MET-TKI治疗MET14号外显子跳跃突变疗效更优,特别是治疗初治的MET突变的NSCLC患者。
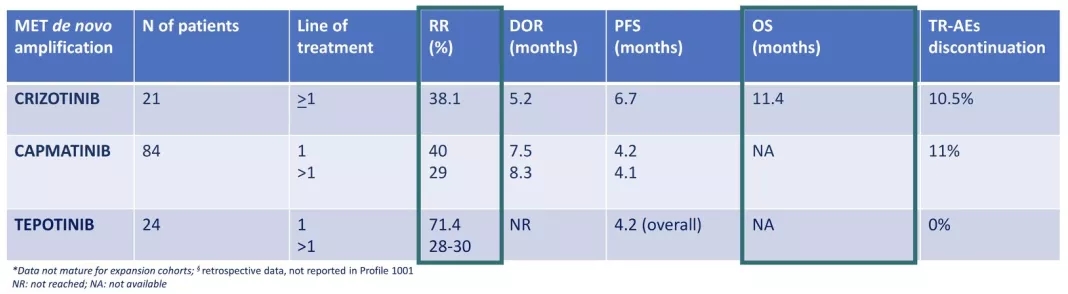
卡马替尼一线治疗MET14号外显子跳跃突变,OS为20.8个月,二线治疗OS为13.6个月。一线治疗ORR为65.6%,二线ORR为51.6%。
卡马替尼一线治疗MET扩增的患者,ORR为40%,二线ORR为29%,而OS尚未达到。
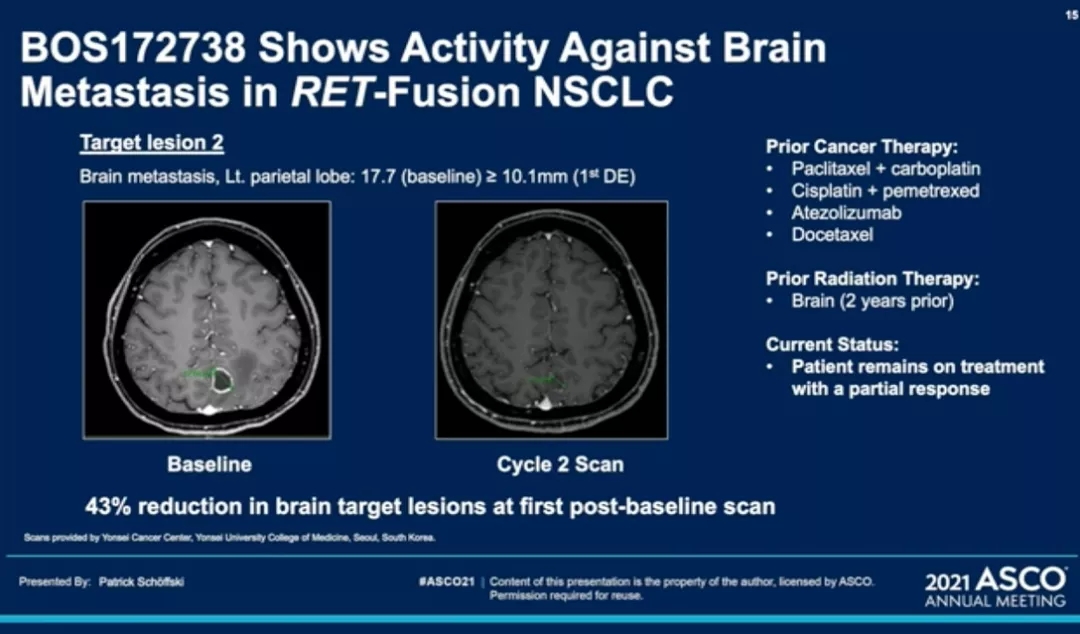
【RET】新药BOS172738,后线治疗RET融合和突变均有效,且入脑效果好
BOS172738是一款针对RET异常突变的靶向抑制剂,今年ASCO报道了BOS172738治疗RET融合的NSCLC 和RET突变的 MTC的I期临床试验,包括剂量递增和队列扩展组。截止2020年12月11日,共纳入67 例 RET 改变的晚期实体瘤患者,其中NSCLC患者为30例,MTC患者有16例。每天接受一次口服 BOS172738(10-150 毫克)。主要研究终点是安全性、耐受性和确认的总体反应率(ORR;RECIST 1.1)。
结果显示:
01 安全可控:BOS172738 显示出良好的长期给药安全性 ,大多数治疗出现的不良事件 (TEAE) 都为 2 级。最常见的 TEAE 是肌酐磷酸激酶 (CPK) 升高 (54%)、呼吸困难 (34%)、面部水肿、天冬氨酸转氨酶升高、贫血(各 25%)、中性粒细胞减少症、腹泻(各 22%)、疲劳(21%)和便秘(20%)。BOS172738 与高血压或肝毒性无关。
02 BOS172738 后线治疗,研究者评估的 整体疗效ORR 为 33% (n=18/54),NSCLC对列 ORR 为 33% (n=10/30),MTC 对列ORR 为 44%(n=7/16,包括 1 例完全缓解)。
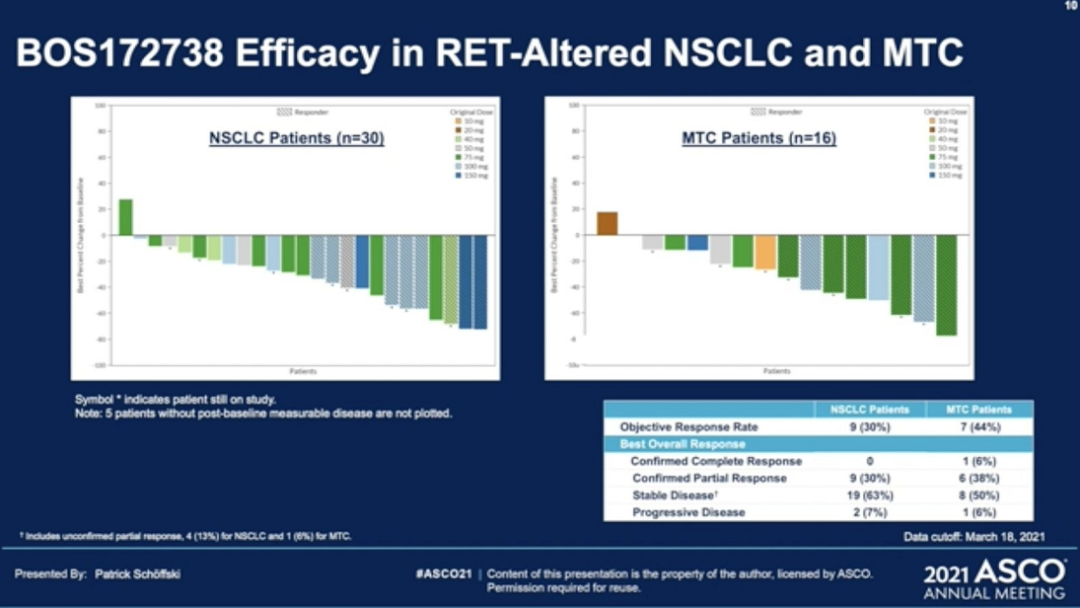
此外会议还报道了一例 RET 融合的 胰腺癌患者病灶部分缓解。该药物对脑转移也有一定的抑制作用,脑部病变减少了 43%。目前尚未达到中位反应持续时间。许多患者仍在研究中,包括最长的 659 天,BOS172738 将继续在 NSCLC、MTC 患者和先前接受过其他选择性 RET 抑制剂治疗的患者中进行评估。
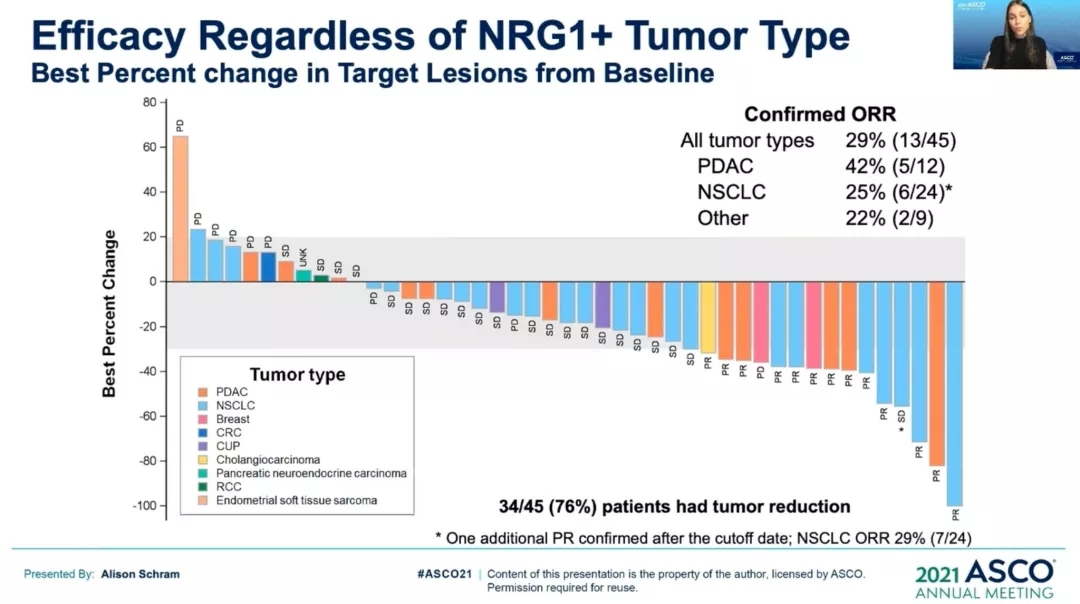
【NRG1】Zenocutuzumab治疗NRG1阳性NSCLC,ORR为25%
Zenocutuzumab是一种非常强大的双特异性抗体,可与HER2和HER3受体结合,从而阻断HER3及其配体神经调节蛋白1(NRG1)或NRG1融合蛋白的相互作用,因此对于NRG1基因融合的患者效果显著。2021年1月8日,FDA授予一款全新的药物Zenocutuzumab(Zeno,MCLA-128)快速通道资格,用于治疗接受标准疗法后疾病进展的携带NRG1基因融合的转移性实体瘤患者。此次获批基于Ⅰ/Ⅱ期eNRGy试验(NCT02912949),该研究纳入NRG1融合阳性的胰腺癌,NSCLC以及其他实体瘤患者,整体ORR为29%,其中胰腺癌患者ORR为42%,其中治疗NRG1融合阳性的NSCLC患者,ORR为25%。整体不良反应可控。
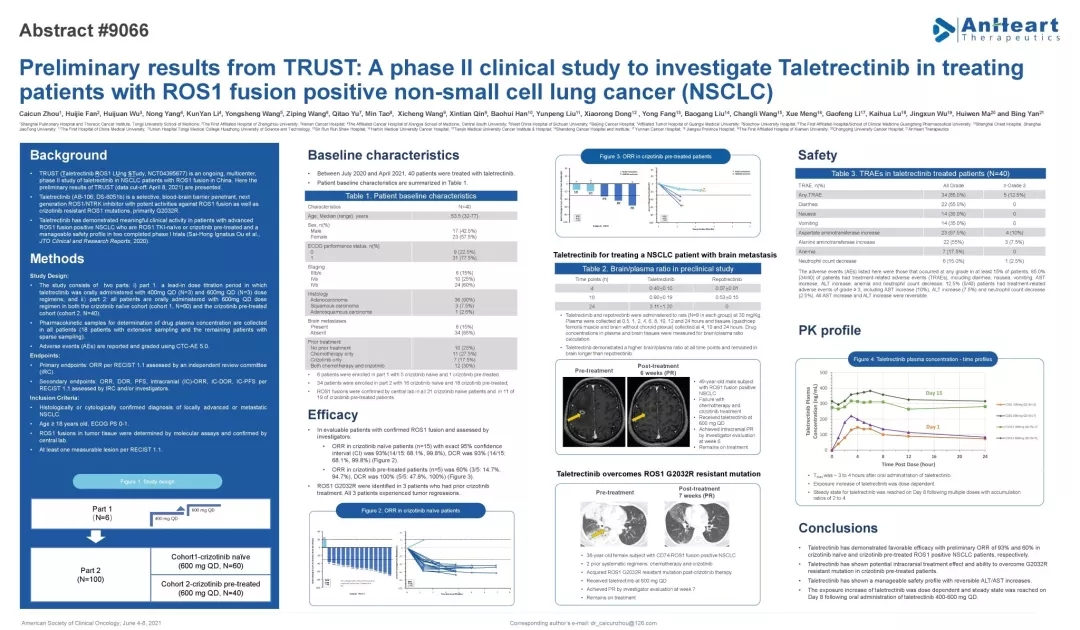
【ROS1】Taletrectinib治疗初治或经治ROS1融合的NSCLC均有效,ORR高达93%
今年ASCO会议中以壁报形式报道一项Taletrectinib (AB-106; DS-6051b)用于治疗ROS1基因融合阳性的非小细胞肺癌的临床Ⅱ期试验“TRUST研究结果。截止2021年4月8日,共有15例未经过克唑替尼治疗和5例接受过克唑替尼治疗的ROS1融合阳性非小细胞肺癌患者入组治疗,并接受过至少2次肿瘤评估(研究者评估),结果如下:
在未经过克唑替尼治疗的患者中(n=15),客观缓解率(ORR)为93%(14/15),疾病控制率(DCR)为93%(14/15);
在曾接受过克唑替尼治疗的患者(n=5)中,客观缓解率(ORR)为60%(3/5);疾病控制率(DCR)为100%(5/5)。5例患者中,3例患者ROS1 G2032R耐药突变阳性,且都有肿瘤缩小的表现。
Taletrectinib安全性可控,主要表现为胃肠道不良事件和可逆的AST、ALT升高。
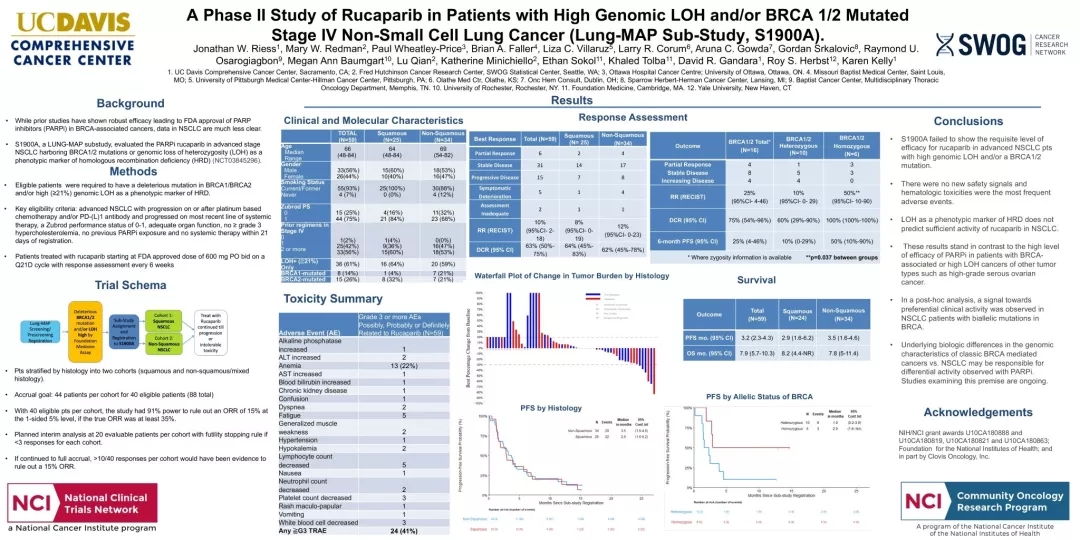
【BRAC1/2】rucaparib治疗BRCA1/2突变或LOH缺失的NSCLC,DCR为37%
Lung-MAP是一项生物标志物驱动、多药、多组、II/III期注册临床试验,该研究共纳入59例可进行疗效评估的NSCLC患者(非鳞NSCLC患者为34例,肺鳞癌为25例)。36例患者(61%)只出现LOH丢失,4例(7%)只出现BRAC1突变,11例(19%)患者只出现BRAC2突变,4例(7%)患者同时BRCA1 + LOH high,4例(7%)患者同时BRCA2 + LOH 高。
结果显示:整体患者的ORR为6%(4例非鳞+2例肺鳞),DCR为37%。整体PFS为3.2个月,在nsq队列中,PFS中位数为3.5个月,在sq队列中为2.9个月。整体中位OS为7.9个月,在肺鳞队列中OS为8.2个月,在非鳞癌队列中,中位OS为7.8个月。最常见的3级不良事件为贫血(22%)、淋巴细胞减少(8%)、疲劳(8%)和筋膜炎(5%)。
— 乳腺癌 —
【HER2】国产RC-48除了治疗HER2高表达,针对HER2低表达疗效也不错
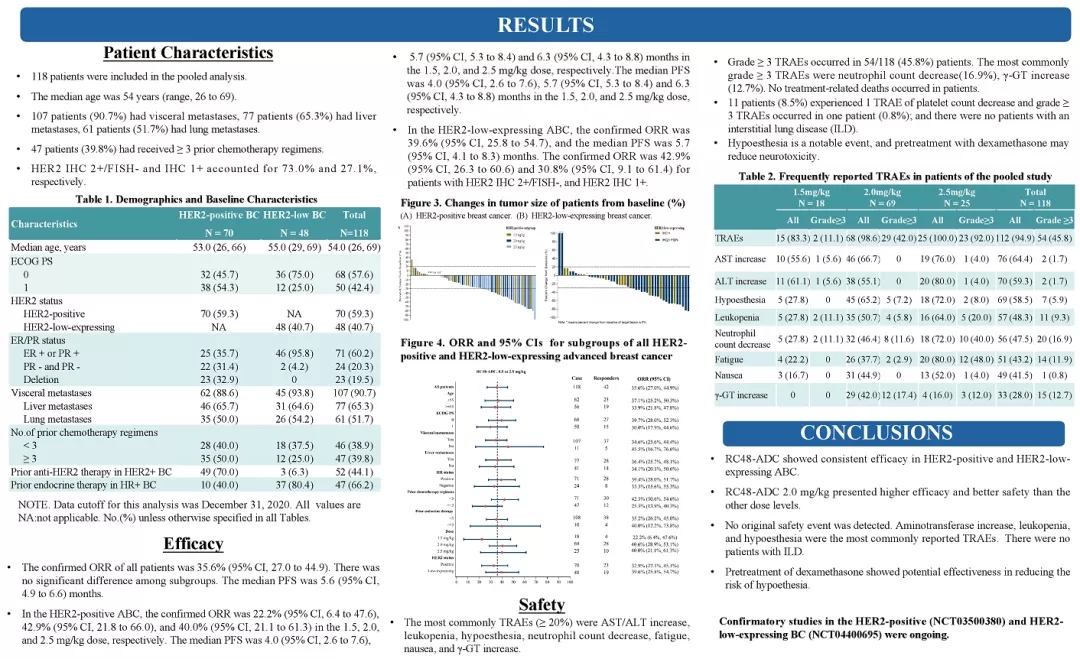
RC48为荣昌生物研发的一款针对HER2的ADC型药物。此次ASCO公布了RC-48治疗ER2阳性和HER2低表达的晚期或转移性乳腺癌患者的研究数据。该分析涉及C001 CANCER (NCT02881138) 和C003CANCER (NCT03052634) 两项研究。截止到2020年12月31日,共纳入118例乳腺癌患者,其中HER2阳性(IHC 2+/FISH-)的患者有70例 (59.3%),HER2低表达的患者有48例(40.7%)。所有患者均接受了RC48-ADC治疗。
结果显示:整体患者的ORR为35.6%,ORR亚组分析没有显著性差异。中位PFS为5.6个月。其中RC-48在剂量为1.5,2.0,2.5mg/Kg时,HER-2阳性患者的ORR分别为22%,42.9%,40%。中位PFS为4.0个月,5.7个月和6.3个月。在HER2低表达亚组中,ORR和mPFS分别为39.6%和5.7个月。而IHC 2+/FISH-以及IHC+的HER2阳性患者的ORR分别为42.9%(15/35)和30.8%。
【HER2】随访30个月,图卡替尼三联体显著改善HER2+患者OS达5.5个月
图卡替尼(TUC)是一种口服酪氨酸激酶抑制剂(TKI),对HER2有高度特异性。在HER2CLIMB研究中评估了曲妥珠单抗+卡培他滨±图卡替尼用于HER2阳性转移性乳腺癌患者的疗效和安全性。
HER2CLIMB(NCT02614794)是一项全球性、随机、双盲、安慰剂对照试验,针对局部晚期或转移性HER2+乳腺癌,既往接受过曲妥珠单抗、帕妥珠单抗和T-DM1的患者,包括未治疗、治疗稳定或治疗进展的BM患者。共有612例患者按2:1随机接受图卡替尼300 mg BID+曲妥珠单抗+卡培他滨或安慰剂+曲妥珠单抗+卡培他滨。
经过30个月的随访,图卡替尼组得到了显著的OS改善5.5个月(24.7个月vs19.2个月,HR0.73)。
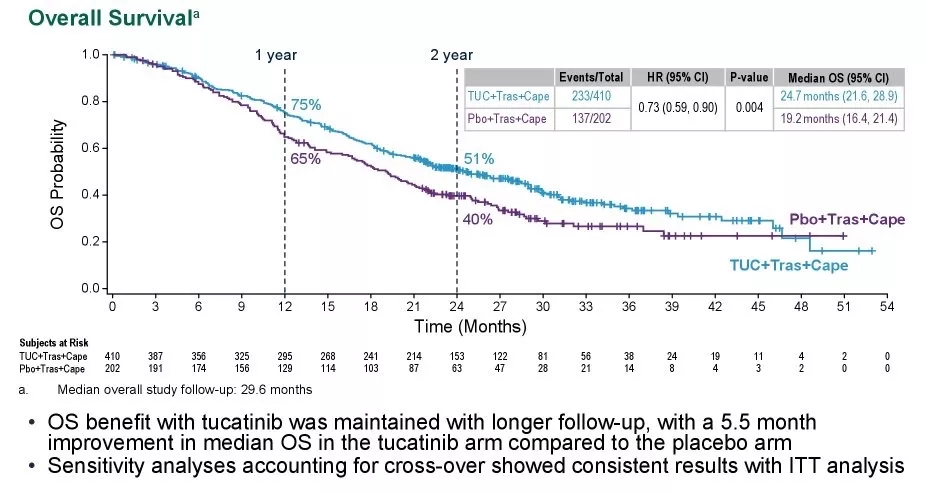
最常见(超过20%)的不良反应包括腹泻、恶心、呕吐、口腔炎、AST升高、ALT升高和皮疹。
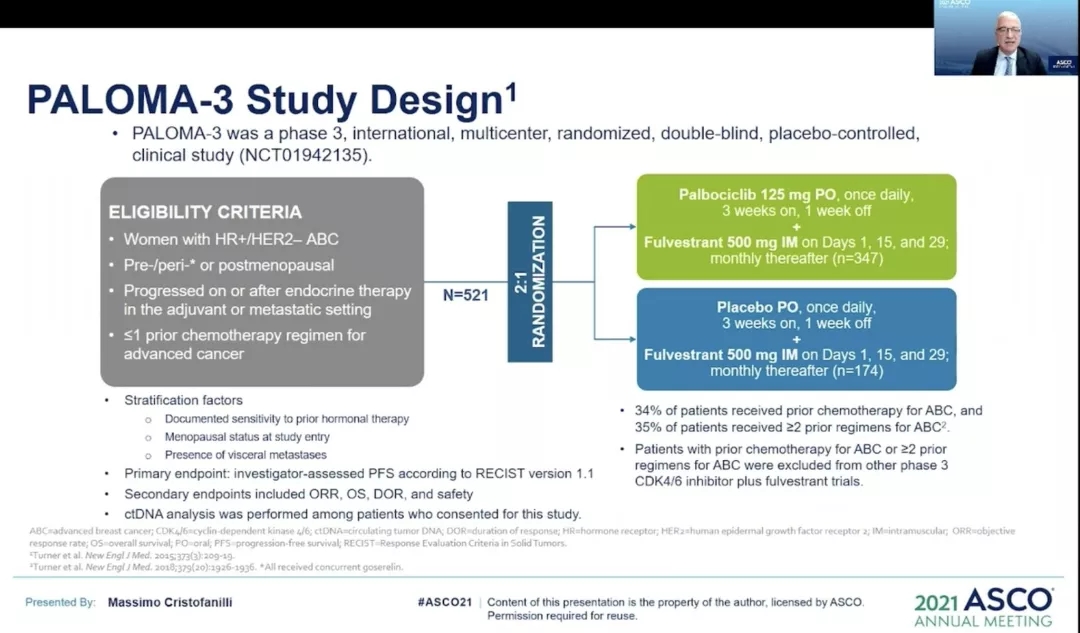
【PALOMA-3数据更新】哌柏西利联合氟维司群5年OS率为23.3%
PALOMA-3研究是一项国际随机,双盲,安慰剂对照试验。共入组521例HR + / HER2- 先前接受过内分泌治疗的乳腺癌患者。按2:1随机接受哌柏西利(125 mg /天,口服3周,每日一次,连续21天,停药1周,周期28天)+氟维司群(剂量为500 mg,根据护理标准,肌内注射,前三次注射每14天一次,之后每28天一次)或安慰剂+氟维司群。
结果显示:中位随访73.3个月后,OS持续得到改善,HR达0.806 (95%CI,0. 654-0. 994;单侧P=0.0221);与安慰剂相比,哌柏西利联合氟维司群组显著延长了患者无进展生存期(PFS)。哌柏西利联合氟维司群组的5年OS率为23.3%(95%CI 18.7-28.2),安慰剂联合氟维司群组为16.8%(95%CI 11.2-23.3)。除了内分泌耐药或曾接受过化疗的患者外,在多数亚组中均观察到了OS改善。
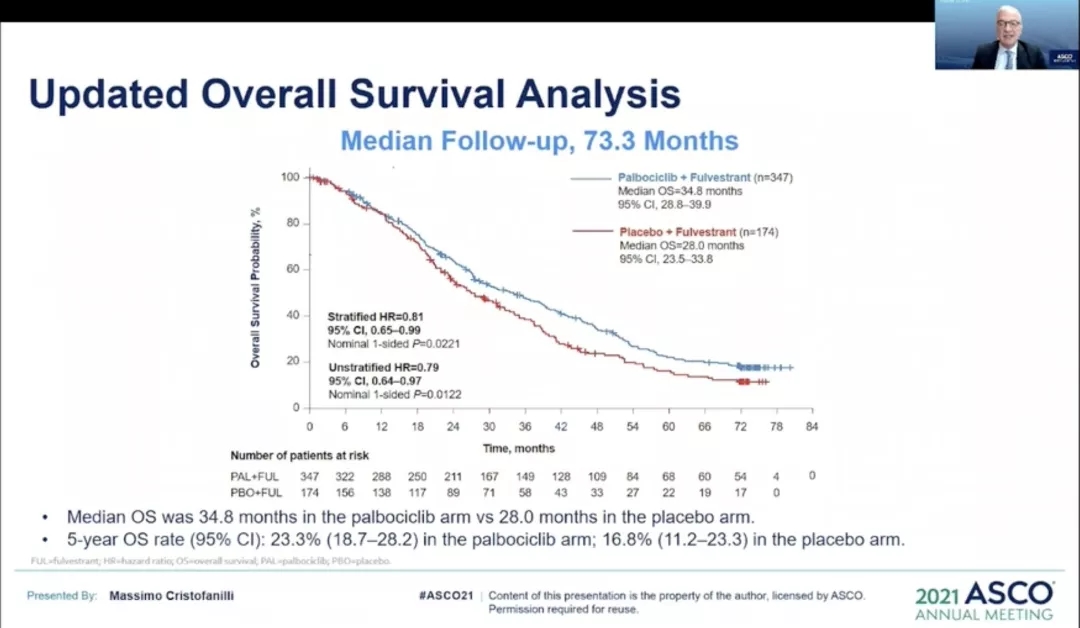
目前有18例患者仍在接受治疗,包括15例(4.3%)接受哌柏西利联合氟维司群治疗,3例(1.7%)接受安慰剂联合氟维司群治疗。哌柏西利联合氟维司群组和安慰剂联合氟维司群组中分别有20例(7.5%)和32例(22.2%)患者还接受了后续的CDK4/6抑制剂治疗。
【一线治疗HR+乳腺癌】“去化疗”方案有望成真!
sysucc-002是一项开放标签、非劣效性、3期、随机、对照试验。旨在比较曲妥珠单抗联合内分泌治疗或化疗一线治疗HR+/HER2+转移性乳腺癌。患者被随机分配(1:1)接受曲妥珠单抗联合化疗(CT组)或内分泌治疗(ET组)。主要终点是无进展生存率,危险比(HR)的非劣效性上限为1.35。
2013年9月16日~2019年12月28日,一共有392例患者纳入了研究,ET组和CT组分别纳入了196例患者,两组雌激素受体阳性(ER+)和孕激素受体阳性(PR+)的患者均为157例(80.1%),两组既往接受过抗HER2治疗的例数分别为41例(20.9%)和48例(24.5%)。
结果显示:在意向治疗人群中,CT组的中位PFS为14.8个月(95%CI 12.8-16.8),ET组为19.2个月(95%CI 16.7-21.7)(HR=0.88,95%CI 0.71-1.09;非劣效性<0.0001);两组总生存(OS)的HR值为0.82(95%CI 0.65-1.04)。
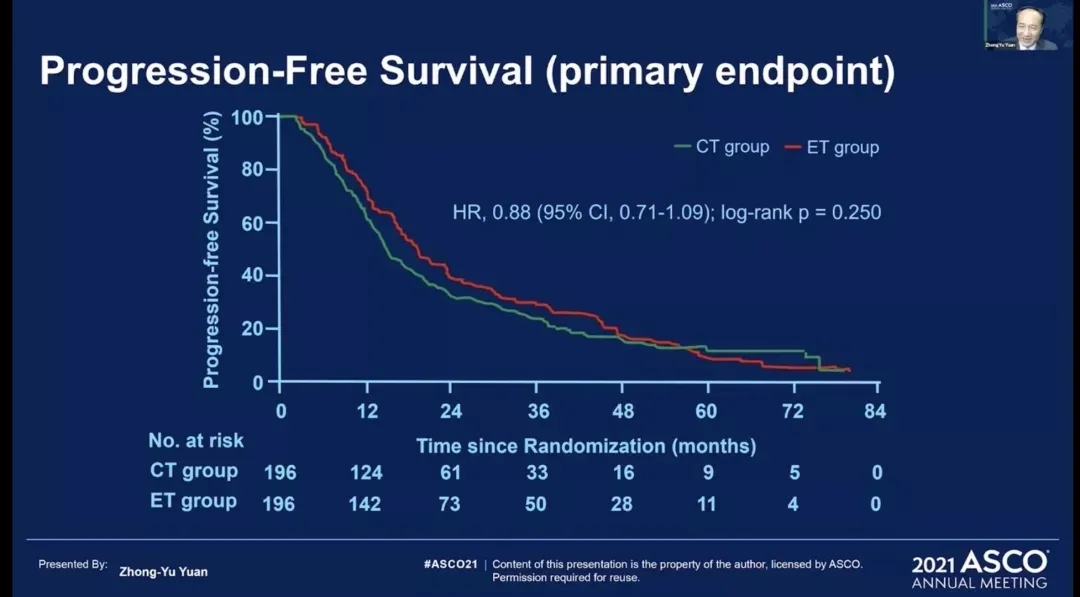
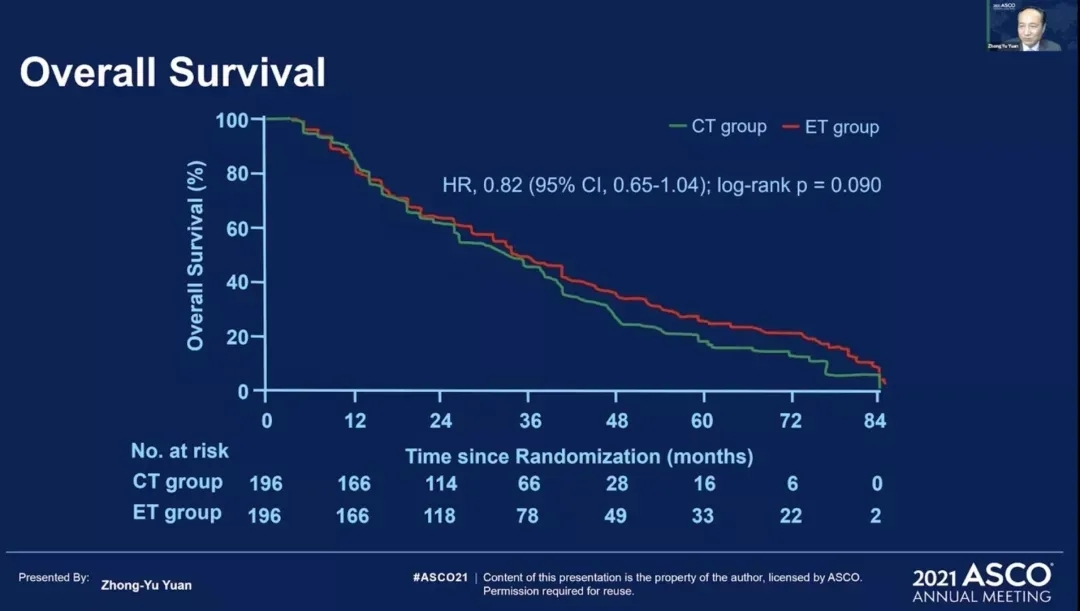
与ET组相比,CT组的中毒发生率明显较高,包括:白细胞减少(98[50%]vs6.6%)、恶心(93%[47%]vs24[12%])、疲劳(47%[24%]vs31[16%)、呕吐(45[23%]vs12[6%])、头痛(65[33%]vs24[12%])、脱发(125[64%]vs8[4%])。
— 胃癌 —
【Keynote 811研究】K药联合曲妥珠+化疗占领Her2阳性胃癌一线
5月5日,FDA正式批准K药+曲妥珠单抗+化疗(FP或CAPOX方案)用于HER2阳性的晚期胃癌及胃食管交界处肿瘤GEJ的一线治疗。此次FDA批准的适应症是基于Keynote 811研究,一项正在开展的全球多中心III期临床研究,此次ASCO则报告了该研究的最新数据。共纳入264例既往未经治疗、不能切除或转移性HER2+G/GEJ癌症患者,随机1:1分为帕博利珠单抗+曲妥珠单抗+化疗组(简称K药组,n=133)和安慰剂+曲妥珠单抗+化疗组(简称安慰剂组,n=131)。双主要终点是根据RECIST v1.1,由盲法、独立中心审查(BICR)评估的PFS和OS。次要终点是根据RECISTv1.1由BICR评估的ORR,DOR 和安全性。
中位随访时间为12.0个月,研究结果显示,K药组的确认ORR为74.4%,安慰剂组为51.9%(P=0.00006);CR率分别为11.3%和3.1%,DCR分别为96.2%和89.3%。中位DOR为10.6个月和9.5个月,预估的DOR≥6个月和≥9个月的患者比例分别为70.3% vs 61.4%,58.4% vs 51.1%。
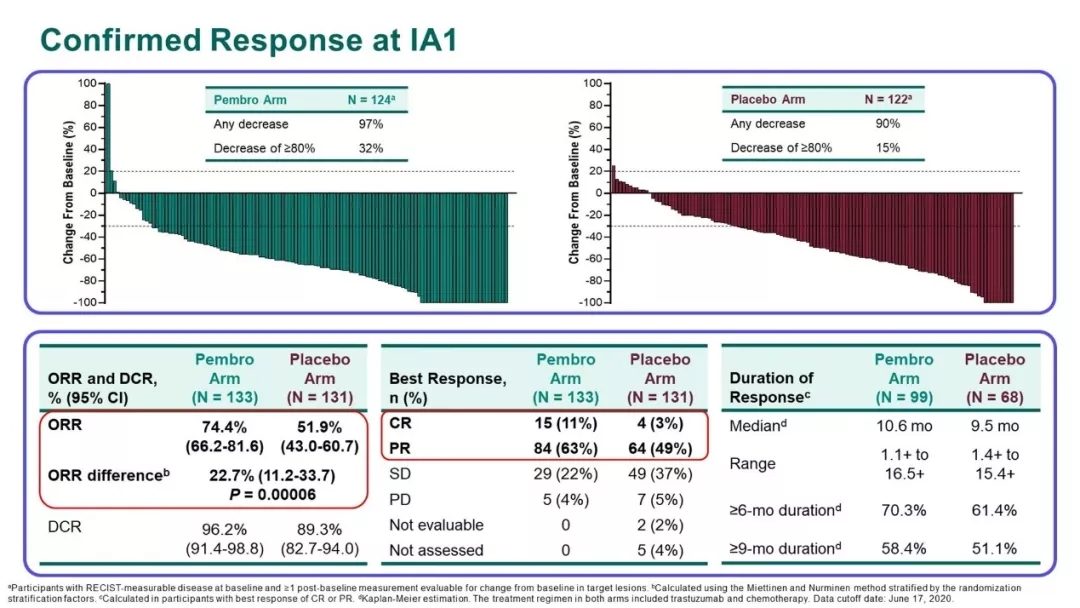
安全性方面,K药组57.1%的患者发生3-5级不良事件,安慰剂组为57.4%。
此次公布的疗效数据显示,加入K药的治疗组的有效率ORR为74%,相比传统治疗方案的有效率52%,明显提升。中位疗效持续时间,两组分别为10.6月:9.5月。期待PFS和OS的数据成熟。至此,继O药联合化疗获得HER2阴性晚期胃癌一线成功的之后,HER2阳性晚期胃癌患者的免疫数据得到补充,O/K在胃癌一线再一次平分秋色!
【DS-8201】治疗经治的HER2阳性胃癌患者,OS为12.5个月
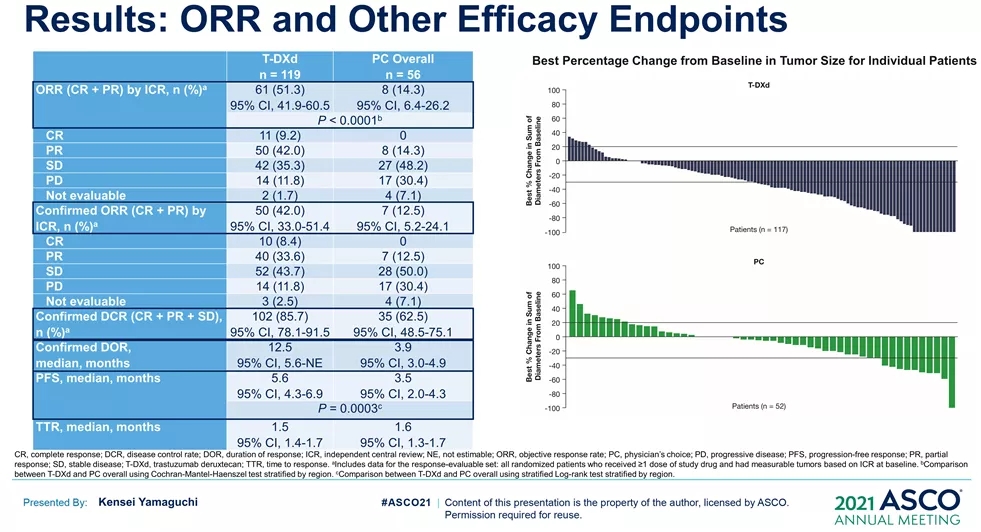
Enhertu(Trastuzumab deruxtecan,T-DXd;DS-8201),是一款针对HER2的ADC型药物,Enhertu的一项随机、多中心治疗 HER2 阳性晚期胃或胃食管交界处 (GEJ) 腺癌的临床Ⅱ期研究(DESTINY-Gastric01),此次ASCO公布了最终OS数据。
共纳入187例患者,几乎全部为亚洲患者(日本:79.7%,韩国:20.3%),125例接受T-DXd;患者中位接受先前2线及以上治疗,44.4%为3 线以上。结果显示:DS-8201与化疗相比,显著延长OS(mOS:12.5vs 8.9 m;HR:0.60);12个月OS分别为52.2%和29.7%。DS-8201组ORR为51.3%(61/119;11 CR,50 PR),而化疗组为14.3%(8/56;全部为PR),确认的ORR(42.0% vs12.5%)、DCR (86.6% vs 62.5%)、mDOR(12.5vs 3.9 m)、mPFS(5.6 vs 3.5 m; HR:0.47)也显著更高。
— 泌尿肿瘤 —
【FGFR】阿替利珠单抗+瑞戈替尼治疗FGFR1/3高表达尿路上皮癌,DCR为83%
FGFR成纤维细胞生长因子受体(共包含FGFR1-4)属于跨膜受体酪氨酸激酶(RTK)家族,与多种恶性肿瘤的发生、增殖、转移和分化相关。在众癌种中,尿路上皮癌FGFR的变异检出率最高,高达30%以上。但目前FGFR的靶向药物较少,美国时间2019年4月12日,FDA加速批准 Balversa (Erdafitinib,厄达替尼) 用于治疗携带有FGFR3或FGFR2突变的铂类化疗后疾病进展的局部晚期或转移性膀胱癌成人患者,包括新辅助或辅助铂化疗12个月内的患者。成为了首款获批针对转移性膀胱癌的靶向药物。但一线治疗仍然以铂类化疗为主。今年,FDA肿瘤药专家咨询委员会(ODAC)以10:1支持加速批准T药用于不符合顺铂治疗的局部晚期或转移性尿路上皮癌患者的一线治疗,顺利进军尿路上皮癌一线。瑞戈非尼Regorafenib是一种有效的VEGFR2和VEGFR3抑制剂,本次大会公布了阿替利珠单抗联合瑞戈非尼一线治疗FGFR1/3高表达、顺铂不耐受的mUC患者的数据。

研究纳入26例患者,截止2021年2月8日,24例患者纳入分析,结果显示,ORR58%,DCR83%。

总之,对于铂类不耐受的尿路上皮癌患者,阿替利珠单抗一线治疗疗效较好,已经获得FDA批准,联合瑞戈非尼后,疗效抗打,为FGFR1/3高表达的尿路上皮癌患者开辟了一条新思路。
文章来源:找药宝典























