FDA批准第4款『泛实体瘤抗癌药物』上市,这次需检测dMMR!
发布时间:2021-08-23作者:"近日,FDA加速批准了第4款泛实体瘤抗癌药物dostarlimab-gxly(PD-1单抗)上市,用于治疗错配修复缺陷(dMMR)的复发或晚期实体瘤患者。"
2017年至2020年,连续四年,FDA每年都会批准一款基于生物标志物的泛实体瘤抗癌药物及其适应症,涉及的药物有帕博利珠单抗(pembrolizumab),拉罗替尼(larotrectinib)及恩曲替尼(entrectinib),涉及的生物标志物有MSI-H/dMMR,NTRK基因融合及TMB-H。

▲ 2017-2020年,FDA批准的泛实体瘤抗癌药物
不出所料的是(连续五年),2021年8月17日,FDA批准了2021年的首款基于生物标志物的泛实体瘤抗癌药物,这也是FDA历史上批准的第4款泛实体瘤抗癌药物 dostarlimab-gxly(PD-1单抗),用于治疗在先前治疗中或之后进展且没有令人满意替代治疗方案的错配修复缺陷(dMMR)的复发或晚期实体瘤患者。

总结三个关键要点,方便大家记忆:
1)泛实体瘤/癌:solid tumors/cancers(不包括血液系统肿瘤);
2)四款泛实体瘤抗癌药物:两款TRK靶向药物(针对NTRK基因融合),两款PD-1免疫药物(分别针对MSI-H/dMMR和TMB-H,以及dMMR);
3)单药后线治疗:单药用于先前治疗中或之后进展且没有令人满意替代治疗方案的泛实体瘤。
1.dostarlimab-gxly
dostarlimab-gxly(商品名JEMPERLI),葛兰素史克(GSK)的PD-1抗体药物,于2021年4月22日首次获得FDA批准用于治疗接受含铂化疗期间或之后疾病进展、错配修复缺陷(dMMR)的复发或晚期子宫内膜癌患者。这是FDA批准的第8款免疫检查点抑制剂(ICIs),也是FDA批准的第4款PD-1单抗。
2021年8月17日,FDA再次批准dostarlimab-gxly的第二个适应症,即用于dMMR复发或晚期实体瘤患者。唯一注意的是,由于既往化疗对高级别胶质瘤患者dMMR检测结果的影响尚不清楚,建议在高级别胶质瘤患者开始替莫唑胺化疗前获得的原发肿瘤标本中检测该标志物(详见药物说明书)。

2.dMMR
dMMR,全称MisMatch Repair-deficient,即错配修复缺陷:错配修复基因功能缺陷导致错配修复蛋白的功能异常,致使MMR修复能力下降或缺失。简言之就是MMR修复机制出现了故障。
dMMR将导致DNA复制过程中的错误累积,进而可能导致癌症。dMMR状态是一种生物标志物,已被证明可以预测对PD-1等免疫检查点抑制剂的反应,具有这种生物标志物的肿瘤最常见于子宫内膜癌、结直肠癌和其他胃肠道癌,但也可能存在于其他实体瘤中。根据文献综述和荟萃性分析,美国泛实体瘤中dMMR的流行率约为14%。
为什么说dMMR的实体瘤免疫响应会高呢?机理就是dMMR会导致无法修复的基因在各种外在环境影响下开始突变,越来越多,肿瘤突变负荷(TMB)增加,进而产生了相关新生抗原,致使淋巴细胞受到调动,抑制肿瘤生长,形成肿瘤浸润淋巴细胞。
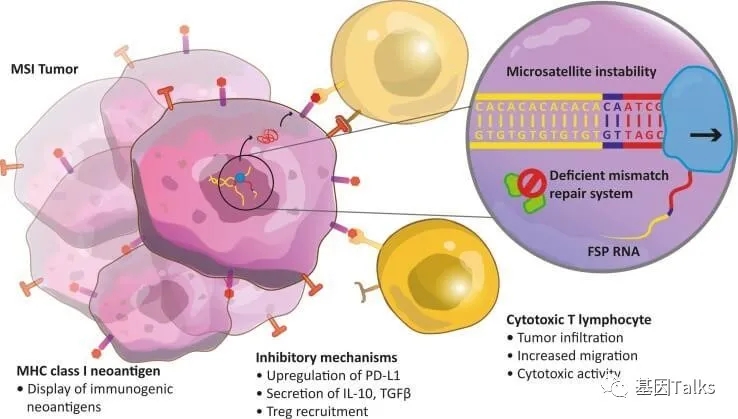
▲ dMMR肿瘤细胞特别容易受到ICIs的影响
3.临床试验
此次加速批准是基于一项非随机、多中心、开放标签、多队列的GARNET试验 (NCT02715284),该试验入选了209例复发或晚期dMMR实体瘤患者,这些患者在先前系统治疗后进展且没有令人满意的替代治疗方案。患者每3周接受dostarlimab-gxly 500mg,共4次,随后每6周静脉滴注1000mg,直到疾病进展或出现不可接受毒性。
主要疗效终点是根据 RECIST 1.1 由盲态独立中心评估(BICR)总体反应率(ORR)和反应持续时间(DoR)。ORR 为 41.6%,其中CR为9.1%,PR为32.5%。中位DOR为 34.7 个月,95.4%的患者持续时间≥6个月。

具体的dMMR肿瘤类型的疗效结果如下图:包括的实体肿瘤有子宫内膜癌,结直肠癌,小肠癌,胃癌,胰腺癌,胆管癌,肝癌,卵巢癌,肾上腺癌,乳腺癌,食管癌,生殖肿瘤,女性恶性胸膜癌,肾细胞癌,不明原发灶癌。

dMMR实体瘤患者最常见的不良反应(≥20%)是疲劳/虚弱、贫血、腹泻和恶心。最常见的3级或4级不良反应(≥2%)是贫血、疲劳/虚弱、转氨酶升高、败血症和急性肾损伤。免疫介导的不良反应也与dostarlimab-gxly相关,包括肺炎、结肠炎、肝炎、内分泌疾病、肾炎和皮肤毒性。
参考资料:
1.https://www.fda.gov/news-events/press-announcements/fda-approves-first-cancer-treatment-any-solid-tumor-specific-genetic-feature
2.https://www.fda.gov/drugs/fda-approves-larotrectinib-solid-tumors-ntrk-gene-fusions-0
3.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-entrectinib-ntrk-solid-tumors-and-ros-1-nsclc
4.https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-pembrolizumab-adults-and-children-tmb-h-solid-tumors
5.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-dostarlimab-gxly-dmmr-advanced-solid-tumors
6.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-dostarlimab-gxly-dmmr-endometrial-cancer
7.Lorenzi M, et al. Epidemiology of microsatellite instability high (MSI-H) and deficient mismatch repair (dMMR) in solid tumors: a structured literature review. J Oncol. 2020.
文章来源:基因talks
声明:本文信息仅供交流分享,并非治疗方案推荐,请遵从医生或其他医疗卫生专业人士的意见或指导。
>






















